用digital PCR進行定量結果一定準確嗎?
Digital PCR(dPCR)是繼即時螢光定量PCR之後新興起來的一種核酸絕對定量分析技術,透過將含有待測樣本PCR reaction分散到成千上萬個獨立的微反應單元(partitions)中,在PCR擴增後對每個微反應單元中的螢光信號進行判讀,計算出陰性和陽性反應的數量,最後利用泊松分佈等統計學公式和軟體對結果進行計算分析,從而實現目標分子的絕對定量。dPCR不依賴標準曲線定量,並且不受PCR擴增效率影響,具有更高靈敏度和準確度。
1.原始樣本濃度
在進行dPCR檢測之前需確定樣本的原始濃度,從而避免由於樣本濃度過高出現所有微反應單元全部都呈現陽性反應或濃度過低出現所有微反應單元全部陰性反應,導致統計學公式計算偏差而造成檢測結果的不準確。一般來講樣本的原始濃度需在數字PCR的動力學檢測範圍內(大多為5個數量級),理想情況下當陰性分區為總分區數的20.3%時,樣本濃度最佳[1]。
2.樣本體積輸入量
當digitla PCR partitions一定時,樣本可以放入的體積同樣會影響到最終的檢測準確性[1]。譬如對於稀有目標分子的檢測,假設待測原始樣本每5ul中含有1個拷貝的目標分子,如果只取5ul樣本加入反應,由於泊松分佈的原理,這個目標分子很可能未被包含在5ul的原始樣本中。如果樣本體積增加到15ul,就會大大提高待測樣本中該目標分子的檢測機率,從而提高檢測結果的準確性和精確性[2]。QIAGEN dPCR的26K Nanoplate採用40ul超大反應體積,配合4X QIAcuity Probe MasterMix可實現高至28ul的待測樣本輸入量,對稀有目標的檢測非常靈敏。
3.數位PCR微反應(Partitions)分區方式量
目前dPCR的分區方式主要為固相物理分割和 “油包水” 的液滴分區兩種。無論選擇哪一種分區方式都可實現泊松分佈概率學統計公式來校正和計算目標分子的最終拷貝數。然而泊松分佈計算準確的前提是需要保證每個微反應單元體積大小一致。“油包水” 液滴生成的過程中,每個液滴的體積 (大小無法保證完全相同。液滴之間由於液體表面張力、操作不當等影響,導致其部分發生融合和破裂。融合使液滴體積變大,破裂則導致有效分區數量變少更增加了交叉污染的風險。另外,還需注意微反應單元密閉與否[1] [3]。非密閉體系在PCR反應過程中,由於受熱會造成反應體系內水分蒸發,從而造成反應體系體積變小,反應濃度隨之增加,同樣也會導致最終檢測結果的偏差。

QIAcuitydPCR搭配的Nanoplate採用獨特奈米微孔板,利用微流體技術將數位PCR反應體系分配到固相微孔中,並在分區完成後自動封閉所有微孔聯通管道,真正實際上建立獨立封閉微反應體系。

4.樣本反應液總有效分區數
有效分區數一般來講是指最終生成含有反應液的可被計算到最終統計學公式中的微反應單元數。從上面的介紹中我們已經知道,不同的分區方式會影響到最終有效分區數。另外,如何確定實際生成的有效分區數也很關鍵。泊松分佈統計是根據有效分區數而非理論分區數來計算的。QIAcuity dPCR MasterMix 包含特殊品管螢光,配合QIAcuity數位PCR系統的reference chanels可即時檢測實際生成的微反應單元數。實測發現QIAcuity 26K Nanoplate最終生成的有效分區數都在25000個以上,與理論值26000的一致性在96%以上,有效避免了最終無效分區的引入和有效分區數量的減少而造成的結果偏差。
5.手工操作誤差
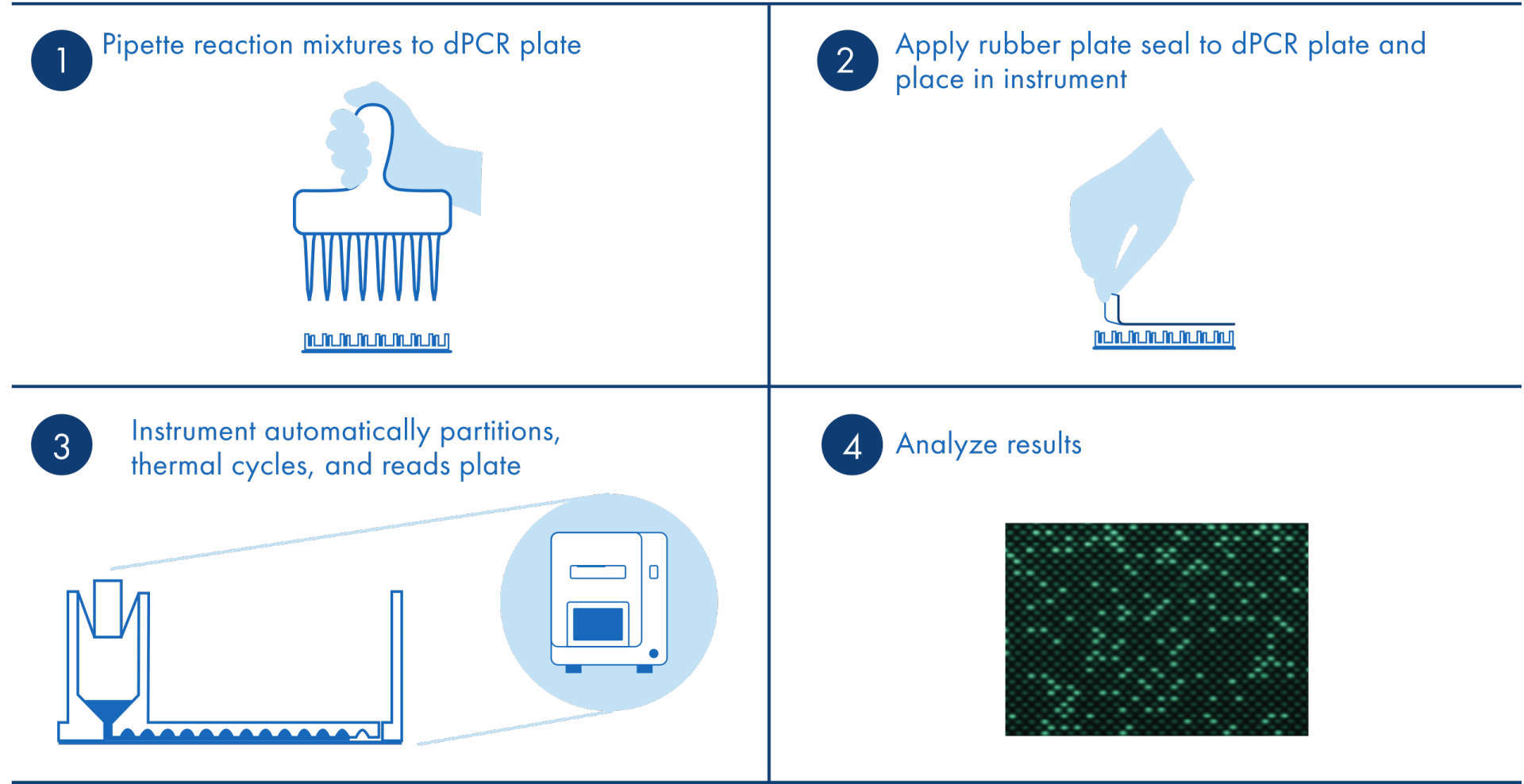
dPCR的實驗操作流程與螢光定量PCR相似,不同之處在於多了一步微反應單元製備。從上面的介紹我們已經瞭解到,微反應單元製備的成功與否直接影響到最終數字PCR的結果。想要提高數字PCR結果的再現性及準確性,就要盡可能避免手工操作步驟的誤差。QIAcuity全自動數位PCR系統,只需在上樣後將奈米微孔板加入儀器中就能實現微孔製備、PCR擴增、螢光資料讀取全流程的自動化,有效避免手動操作引入的誤差,是檢測結果準確的可靠保證。
![]() 同場加映: 選擇您最想要的digital PCR應用即有機會獲獎 :
同場加映: 選擇您最想要的digital PCR應用即有機會獲獎 :
請選擇下列digital PCR 技術應用,即有機會獲獎 請立即點選圖卡(請優先使用智慧型手機操作並開啟LINE內建描器)





